.
Principais conclusões
- Verifique os cabos que conectam a CPU ao monitor e certifique-se de que estejam firmemente conectados.
- Desconecte todos os dispositivos externos e verifique se as configurações de projeção estão configuradas corretamente.
- Reinstale os drivers de vídeo ou execute uma restauração do sistema se o Windows continuar exibindo uma tela preta durante a inicialização.
Uma tela preta na inicialização pode ser frustrante. Sem informações visíveis na tela, identificar o problema subjacente pode ser complicado. No entanto, existem algumas coisas que você pode fazer para corrigir o problema da tela preta no Windows 10 e no Windows 11.
1. Verifique se o Windows responde
Primeiro, é importante verificar se o seu computador e o Windows estão inicializando. Para fazer isso, pressione Ganhar + Ctrl + Shift + B. Isso reiniciará o driver gráfico e produzirá um bipe.
Se você ouvir um bipe, o Windows está respondendo. No entanto, se você não ouvir nada, significa que o seu computador não está inicializando. Nesse caso, pode ser necessário reparar um PC que não inicializa ou consertar uma tela preta mortal.
2. Verifique seu monitor e cabos
Isso pode parecer simples, mas é crucial verificar a conexão do monitor, caso ainda não o tenha feito. Comece removendo todos os cabos do monitor e reconecte-os com firmeza para garantir que estejam conectados com segurança. Além disso, certifique-se de que seu monitor esteja realmente ligado.
Se puder, use outra conexão de monitor. Por exemplo, mude de HDMI para DisplayPort. Como alternativa, use um cabo novo. Isso o ajudará a determinar se o problema está na porta do monitor ou no cabo. Você também pode tentar conectar seu monitor a um computador diferente, se disponível, para verificar se o monitor está com defeito.
3. Desconecte seus dispositivos externos
Desligue o computador e desconecte todos os dispositivos externos, incluindo mouse, teclado, disco rígido externo e qualquer outra coisa. Reinicie o computador e veja se a tela preta ainda aparece. Se isso resolver o problema, conecte cada dispositivo, um de cada vez, até descobrir a causa do problema.
Depois de encontrar o dispositivo problemático, tente atualizar seus drivers e talvez seja necessário localizar e substituir drivers específicos, se necessário.
4. Ajuste as configurações de projeção
É possível que as configurações de projeção do seu sistema estejam configuradas incorretamente. Por exemplo, se o seu monitor estiver configurado para projetar em uma segunda tela que não existe, o monitor poderá exibir uma tela preta.
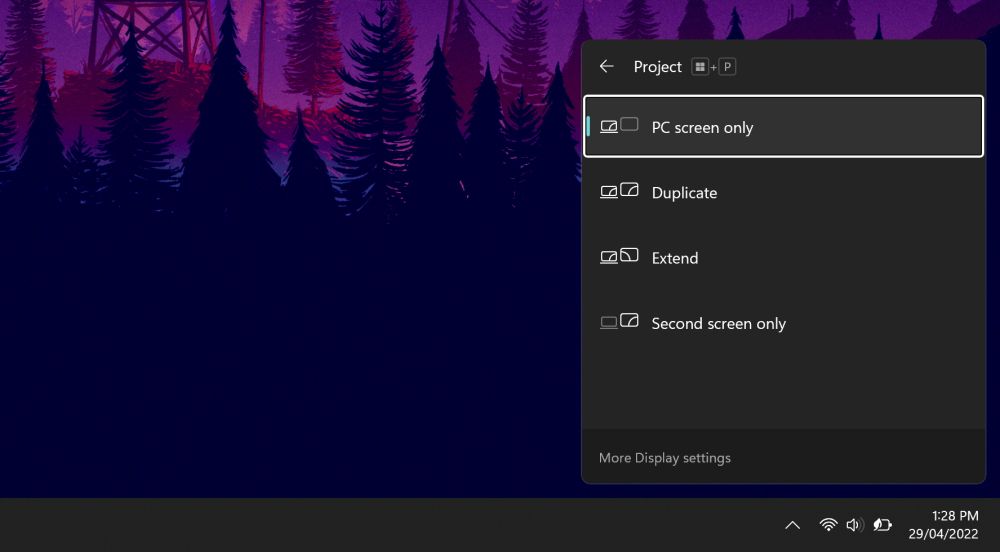
Imprensa Ganhar + P para abrir o menu Projeção. De cima para baixo, as opções são Apenas tela do PC, Duplicado, Ampliare Apenas segunda tela. Embora o primeiro seja o padrão, o seu pode não estar definido para ele.
Imprensa P para destacar a próxima opção e Digitar para selecioná-lo. Como você provavelmente tentará fazer isso enquanto a tela estiver escura, serão necessárias algumas tentativas e erros. Repetir isso quatro vezes retornará à configuração original, embora, esperançosamente, uma das configurações ao longo do caminho restaure sua exibição.
5. Reinstale os drivers de vídeo
Para reinstalar os drivers de vídeo, você precisará inicializar no modo de segurança. O método necessário depende de vários fatores, portanto, siga as etapas apropriadas abaixo e continue lendo para descobrir como reinstalar os drivers de vídeo.
A. Você pode ver a tela de login
- Reinicie o seu computador.
- Na tela de login, segure MudançaClique no Poder ícone e selecione Reiniciar.
- Depois de reiniciado, selecione Solucionar problemas > Opções avançadas > Configurações de inicialização > Reiniciar. Novamente, seu sistema será reiniciado e apresentará diferentes opções.
- Imprensa F5 selecionar Modo de segurança com rede. Se isso não funcionar, siga as etapas anteriores, mas selecione F3.
B. Você não consegue ver nada e tem uma unidade de recuperação
Bom trabalho se você já criou uma unidade de recuperação antes que esse problema ocorresse!
- Desligue o sistema e conecte a unidade de recuperação.
- No Escolha uma tela de opçõesselecione Solucionar problemas > Opções avançadas > Configurações de inicialização > Reiniciar.
- Depois de reiniciado, pressione F5 selecionar Modo de segurança com rede. Se isso não funcionar, siga as etapas anteriores, mas selecione F3.
C. Você não consegue ver nada e não tem uma unidade de recuperação
Você precisa de acesso a um computador funcional para criar a mídia de instalação do Windows 10/11. Baixe o Windows 10 ou Windows 11 da Microsoft e use-o para criar a mídia de instalação. Se precisar de ajuda com isso, consulte nosso guia sobre como criar um ISO inicializável. Em seguida, você precisa definir a ordem de inicialização no BIOS para ler primeiro a mídia de instalação. Novamente, se precisar de ajuda, consulte nosso guia sobre como alterar a ordem de inicialização.
Em seguida, na tela de instalação:
- Selecione Repare seu computador.
- Selecione Solucionar problemas > Opções avançadas > Configurações de inicialização > Reiniciar.
- Depois de reiniciado, pressione F5 selecionar Modo de segurança com rede. Se isso não funcionar, siga as etapas anteriores, mas selecione F3.
Como reinstalar seus drivers de vídeo
Quando estiver no modo de segurança, siga estas etapas:
- Imprensa Ganhar + X e clique Gerenciador de Dispositivos.
- Duplo click o Adaptadores de vídeo categoria.
- Clique com o botão direito sua placa gráfica e selecione Propriedades. Vou ao Motorista aba.
Se disponível, clique em Reverter driverselecione um motivo e clique em Sim. Isso o levará de volta ao driver instalado anteriormente.
Se isso não funcionar ou não for uma opção, selecione Desinstalar para remover o driver completamente. Em seguida, acesse o site do fabricante (provavelmente AMD, NVIDIA ou Intel) e instale um driver mais antigo ou entre em contato com eles para obter suporte.
6. Limpe o interior do gabinete do computador e avalie o hardware interno
Desligue o computador, desconecte tudo e abra-o. Examine todos os seus componentes em busca de sinais de danos. Remova cada componente e recoloque-o, garantindo que esteja firmemente preso.
Se você atualizou recentemente um dos componentes do seu computador, como a placa gráfica ou RAM, certifique-se de que ele esteja instalado corretamente. Talvez seja necessário entrar em contato com o fabricante se a peça estiver com defeito.
O problema da tela preta também pode ocorrer se a unidade de fonte de alimentação (PSU) não estiver fornecendo energia suficiente para suportar as novas peças. Use uma calculadora de fonte de alimentação online para verificar se sua PSU é suficiente para a configuração atual.
Outra coisa a fazer é garantir que o computador não esteja superaquecendo. Manter o PC resfriado prolonga a vida útil dos componentes e ajuda a evitar problemas de tela preta.
Pegue um pano de microfibra e um soprador de ar e use-os para limpar toda a poeira e sujeira de dentro do computador, especialmente dos ventiladores. É melhor fazer isso do lado de fora, se puder, pois isso levantará muita poeira. Tente não deixar que ele se acomode dentro do computador.
7. Use o reparo de inicialização ou execute uma restauração do sistema
Como o nome sugere, executar a ferramenta de reparo de inicialização pode ajudar a corrigir problemas que seu PC com Windows pode encontrar durante a inicialização. Esta ferramenta verificará seu sistema em busca de quaisquer problemas que possam acionar a tela preta na inicialização e tentará corrigi-los.
Se o problema persistir mesmo depois de executar isso, execute uma restauração do sistema como último recurso. Isso permitirá que o Windows reverta quaisquer alterações recentes feitas em seu sistema que possam estar causando o problema de tela preta durante a inicialização.
.