.
O Google diz que quando você ativa o modo Avião pela primeira vez no seu dispositivo Android, o Bluetooth e o Wi-Fi são desligados. Anteriormente, o Google permitia que os usuários mantivessem o Bluetooth funcionando mesmo no modo Avião, a fim de evitar que seus fones de ouvido ou smartwatch com Bluetooth desligassem sempre que o modo Avião fosse ativado. Em outras palavras, por que perder a capacidade de usar seus wearables Bluetooth só porque você está voando?
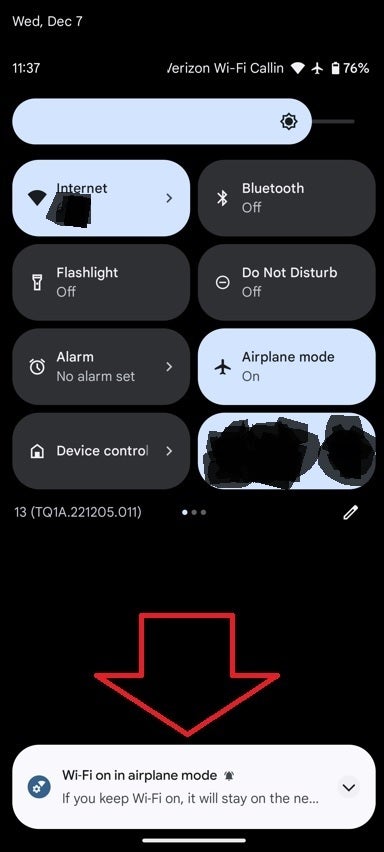
Agora, os usuários do Android poderão manter o Bluetooth e o Wi-Fi ativados quando o modo Avião estiver ativado
Para ativar o modo avião, acesse Definições > Rede e internet > Ativar ou desativar o modo avião. Outra maneira de ativá-lo é deslizar do centro superior da tela para Configurações rápidas. Deslize para baixo novamente e você verá o botão que liga e desliga o modo Avião. Para se conectar a uma rede Wi-Fi, acesse Definições > Rede e internet > Ligue o Wi-Fi. Selecione a rede Wi-Fi correta na lista e você precisará digitar a senha se estiver protegida por uma. Para ativar o Bluetooth, vá para Definições > Dispositivos conectados > Preferências de conexão > Bluetooth. Ligue ou desligue o Bluetooth.
A julgar pela forma como o Google escreveu a página de suporte, esse recurso deve estar disponível para todos os telefones Android. No momento, porém, podemos confirmar que este escritor o recebeu em seu Pixel 6 Pro.
.








