.
Uma equipe de pesquisadores da Escola de Engenharia e Ciências Aplicadas da Universidade de Columbia afirma ter construído com sucesso dispositivos de molécula única que podem ser efetivamente ligados ou desligados usando apenas luz.
De acordo com um Comunicado de imprensa da equipe, esta primeira criação bem-sucedida de dispositivos de “molécula única altamente condutivos e ajustáveis” poderia levar a máquinas ou sensores eletrônicos em nanoescala que são ativados por um único comprimento de onda de luz. Tais dispositivos poderiam oferecer inúmeras aplicações, desde biologia e agricultura até segurança ou mesmo espionagem.
Dispositivos de molécula única podem ser o ponto final natural do encolhimento contínuo da eletrônica
Os dispositivos eletrónicos estão continuamente a diminuir, abrindo um número crescente de possibilidades que antes pareciam ficção científica. Alguns incluem robôs em nanoescala que podem ser injetados no corpo humano para realizar reparos no nível celular. Em contraste, outros incluem coisas como câmeras espiãs em miniatura que podem realizar observações clandestinas à vista de todos.
Infelizmente, os semicondutores tradicionais enfrentam desafios nas menores escalas. Alguns pesquisadores propuseram preencher a lacuna com dispositivos de molécula única que usam moléculas orgânicas para conduzir elétrons. Ainda assim, também enfrentaram desafios, especialmente quando se trata de operá-los externamente.
Agora, os pesquisadores da Columbia dizem ter encontrado um processo para criar dispositivos orgânicos de molécula única que podem ser controlados com luz.
“Com este trabalho, desbloqueamos uma nova dimensão na electrónica molecular, onde a luz pode ser usada para controlar como uma molécula se liga no espaço entre dois eléctrodos metálicos”, disse Latha Venkataraman, pioneira em electrónica molecular e professor Lawrence Gussman de Física Aplicada e professor de química na Columbia Engineering. “É como apertar um botão em nanoescala, abrindo todos os tipos de possibilidades para projetar componentes eletrônicos mais inteligentes e eficientes.”
Usando luz para construir um circuito molecular organometálico
O estudo, Publicados no diário Comunicações da Naturezafoi conduzido por pesquisadores do Departamento de Química da Universidade de Columbia, do Instituto de Física Teórica da Universidade de Regensburg, Alemanha, do Departamento de Química da Universidade do Sul da Califórnia, Los Angeles, e do Departamento de Física Aplicada e Matemática Aplicada, Columbia. Engenharia.
Nessa publicação, os pesquisadores descrevem o trabalho meticuloso que a equipe realizou para transformar seus sonhos de molécula única em realidade funcional. Felizmente, o professor Venkataraman tinha mais de duas décadas de experiência estudando as propriedades subjacentes à ideia de construir circuitos de molécula única com precisão atômica que empregam uma molécula orgânica ligada a cada lado por eletrodos metálicos.
Ainda assim, conectar eletrodos metálicos a moléculas orgânicas baseadas em carbono revelou-se difícil. Isso levou os pesquisadores a considerar a interface dos condutores elétricos metálicos com átomos metálicos já presentes nos átomos organometálicos.
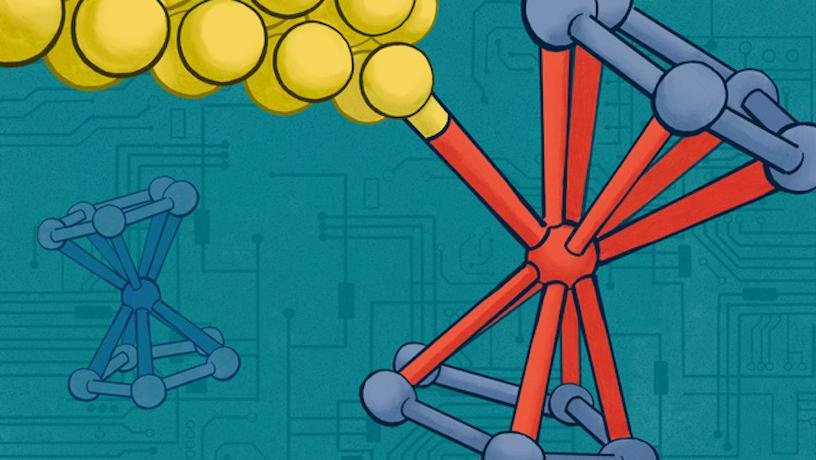
A equipe finalmente selecionou uma molécula organometálica específica de ferroceno contendo ferro que tinha a mistura certa de propriedades orgânicas para funcionar em escala nanométrica e a presença de átomos de ferro dentro da própria célula. Notavelmente, os investigadores salientam que estes tipos de moléculas são frequentemente considerados pequenos blocos de construção no mundo da nanotecnologia.
“Assim como as peças de LEGO podem ser empilhadas para criar estruturas complexas, as moléculas de ferroceno podem ser usadas como blocos de construção para construir dispositivos eletrônicos ultrapequenos”, explica o anúncio do estudo.
Em seguida, a equipe expôs a célula selecionada à luz laser, resultando em uma “ligação direta” induzida eletroquimicamente entre o centro de ferro ferroceno da célula orgânica e os eletrodos de ouro (Au). Isto significa que a equipe construiu com sucesso um dispositivo eletrônico de molécula única que foi essencialmente “ligado” usando apenas a energia da luz.
“Nosso trabalho apoia, portanto, que uma ligação Fe-Au pode ser formada pela manipulação do estado de oxidação do ferroceno usando luz, criando dispositivos de molécula única ligados através de uma interface metal-metal à temperatura ambiente”, explicam os pesquisadores.
“Ao aproveitar a oxidação induzida pela luz, encontramos uma maneira de manipular esses pequenos blocos de construção à temperatura ambiente, abrindo portas para um futuro onde a luz pode ser usada para controlar o comportamento de dispositivos eletrônicos em nível molecular”, acrescentou o líder do estudo. autor, Woojung Lee, Ph.D. estudante no laboratório de Venkararaman.
Aplicações ilimitadas para dispositivos de molécula única controlados por luz
No futuro, os pesquisadores dizem que planejam explorar produtos químicos ainda mais diversos que possam ser usados para criar diferentes tipos de dispositivos de molécula única. Eles também observam um grande potencial em seu processo devido a uma capacidade demonstrada de criar dispositivos de molécula única baseados em ferroceno, comutáveis por luz, que eles também esperam explorar.
“Os dispositivos controlados por luz podem abrir caminho para o desenvolvimento de sensores e interruptores que respondam a comprimentos de onda de luz específicos, oferecendo componentes mais versáteis e eficientes para uma ampla gama de tecnologias”, explicam os pesquisadores.
Christopher Plain é romancista de ficção científica e fantasia e redator-chefe de ciências do The Debrief. Siga e conecte-se com ele no X, conheça seus livros em plainfiction.comou envie um e-mail diretamente para ele em christopher@thedebrief.org.
.