.
Se você não consegue verificar se há novas atualizações de software em seu iPhone e iPad, você não está sozinho. BGR relata que houve vários relatos de usuários que não conseguiram verificar novas atualizações nas últimas 24 horas em várias plataformas.
Apesar de os dispositivos da Apple indicarem que uma atualização está pronta para ser baixada, os usuários são recebidos com um erro ‘Não foi possível verificar a atualização’ quando procuram uma nova atualização de versão.
Uma postagem do Threads indica que o problema não se limita apenas ao iPad e ao iPhone, mas alguns usuários do Apple Watch Series também podem ter sido afetados. O erro diz: “Não é possível verificar a atualização. A verificação de uma atualização de software falhou porque você não está conectado à Internet.”
Há também um post sobre isso no fórum da Comunidade da Apple e muitos usuários no MacRumors’ Os fóruns também o encontraram, sinalizando que muitas pessoas foram afetadas. Da mesma forma, alguns usuários do X, anteriormente conhecido como Twitter, também reclamou sobre o assunto.
O erro não está sendo encontrado apenas por aqueles em software beta, mas também por usuários em versões estáveis. Para alguns, reiniciar seus dispositivos foi suficiente para resolver o problema, mas outros não conseguiram verificar novas atualizações mesmo depois de reiniciar seus iPhones e iPads.
Pode-se teorizar que o erro está relacionado à breve interrupção que foi recentemente experimentada por vários serviços do iCloud e, como a maioria deles foi resolvida, é provável que as coisas voltem ao normal em breve. Caso contrário, se esse bug não tiver nada a ver com o iCloud, você terá que esperar que a Apple chegue ao fundo do problema e emita uma correção.
Acabei de verificar meu iPhone, que está no iOS 16.5.1, e recebi o seguinte erro:
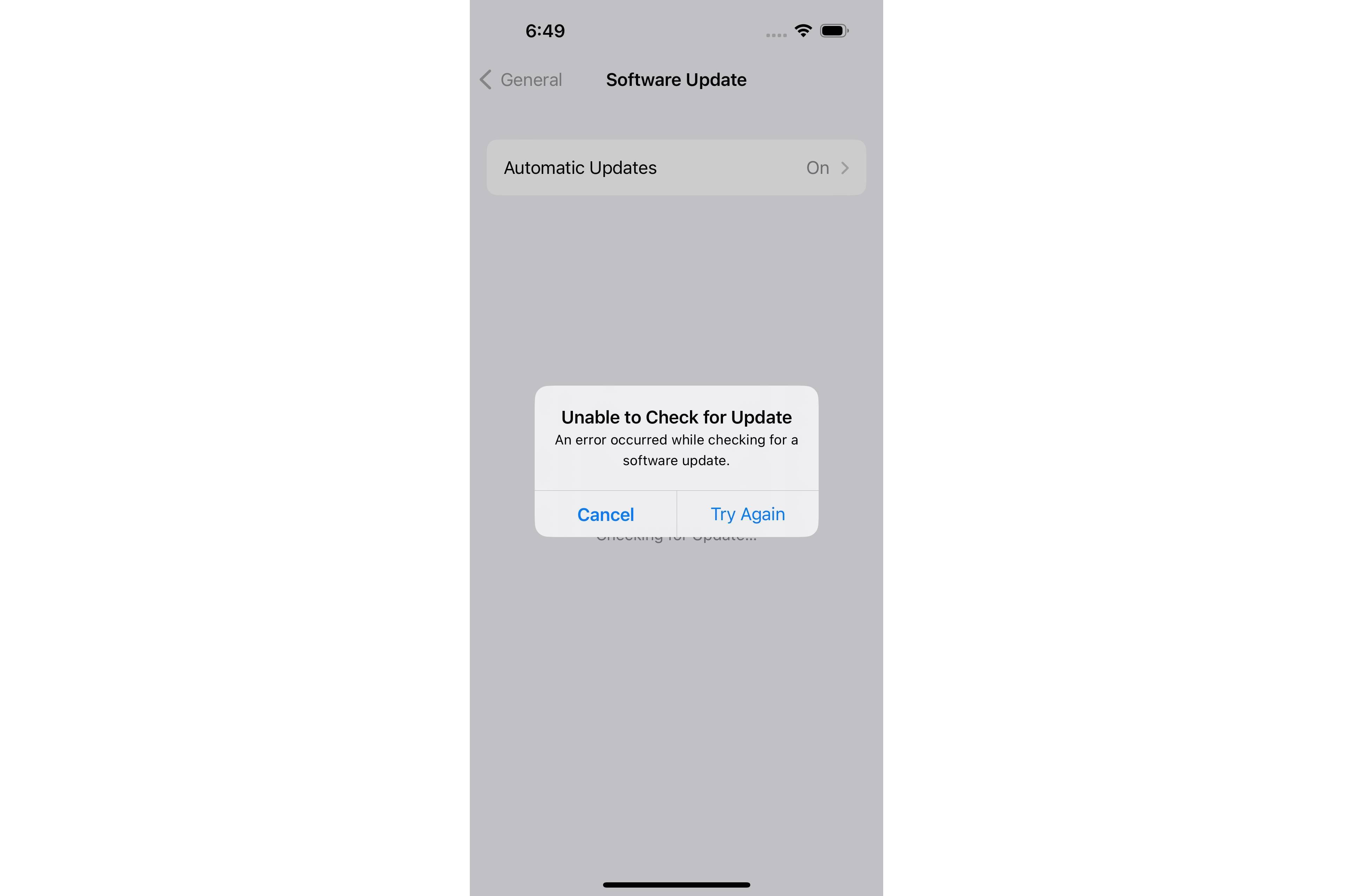
.









