.
Domingo de corrida

Nesta coluna semanal, o editor de wearables do Android Central, Michael Hicks, fala sobre o mundo dos wearables, aplicativos e tecnologia de fitness relacionados à corrida e à saúde, em sua busca para ficar mais rápido e em forma.
Meu treinador de corrida no ensino médio nos disse que a música era uma muleta. O que ele não O que nos contou foi que as responsabilidades dos adultos, uma semana de trabalho de 40 horas e a tentação dos videogames tornariam muito difícil encontrar tempo e motivação para correr! Hoje em dia, fico perfeitamente feliz em procurar os melhores aplicativos e playlists de corrida para servir como muleta motivacional.
Abaixo, vou me concentrar nos aplicativos de corrida e rastreamento de passos que uso (ou usei e gostei) que fornecem motivação por áudio, planejamento de treinamento (e vergonha), motivação social e tudo mais que você pode usar para sair pela porta , correndo no ritmo certo e sustentando esse esforço por tempo suficiente para melhorar.
Meus aplicativos de motivação de áudio favoritos
Vou começar com o óbvio: uma boa lista de reprodução de música é a diferença entre entrar no clima e sentir-se desmoralizado pela respiração ofegante e irregular durante corridas difíceis. Não vou defender um aplicativo de streaming de música específico, mas a maioria dos grandes tem listas de reprodução de exercícios selecionadas que correspondem a frequências cardíacas ou gêneros específicos.
Um treinador de corrida pode dizer para você não confiar na música, mas acho que não há problema se você usá-la com segurança – experimente a condução óssea ou fones de ouvido abertos como o Shokz OpenFit para ouvir o que está ao seu redor – e não treine demais para acompanhar o ritmo músicas. Tento organizar minhas próprias playlists de horas de duração para diferentes durações de corrida ou tipos de treinamento, para ter uma familiaridade confortável com o que está por vir, em vez de ser surpreendido por músicas novas e populares que não são minha preferência.
Além da música, você pode se surpreender ao saber que Audible é um dos meus companheiros de corrida mais utilizados. Sempre que estou treinando para uma maratona e aumentando minha quilometragem, as horas diárias na trilha podem ficar monótonas depois de um tempo, e eu aproveito o tempo para mergulhar em velhos favoritos que irão entreter, mas não distrair. Minha nova audição da série Wheel of Time me levou a dezenas de corridas e caminhadas pós-corrida.

Você não pode errar com Zombies, Corra! e Marvel Move. O aplicativo de uma década começou com uma premissa simples – se você desacelerar, zumbis virtuais iriam assustá-lo ou “comê-lo” se você falhasse – mas adicionou centenas de missões de drama de áudio sobre a sobrevivência pós-apocalíptica como um corredor .
Mais recentemente, eles licenciaram missões da Marvel nas quais você se junta a Thor e Loki, os X-Men e outros heróis populares. Adoro usar essas missões para ritmos acelerados e corridas em pista; embora Audible seja relaxante, mas pode distrair, essas missões vêm em breves momentos de entretenimento que o mantêm concentrado, mas não demore muito para ser bem-vindo antes de voltar para a música.
Caso contrário, se você está procurando um treinamento de áudio mais tradicional, não estou tão familiarizado com os aplicativos do sofá para 5K que existem porque executo mais de 5K há algumas décadas, mas ouvi coisas muito boas sobre as dicas de coaching personalizadas do Aaptiv.
Meus aplicativos favoritos de treinamento e caminhada

Todos os aplicativos de música e coaching acima motivam você quando você já decidiu correr. Mas para aqueles dias de exaustão em que relaxar parece mais atraente? Você precisará de algum tipo de reforço positivo (ou negativo) para se forçar a se preparar e sair de casa, seja para correr ou caminhar.
Sou fã de sistemas de rastreamento como os Minutos de Zona Ativa do Fitbit ou os Minutos de Intensidade da Garmin, que fornecem uma meta semanal a ser atingida e um treino diário recomendado, mas levam em consideração o contexto e dizem para você descansar se estiver fisicamente exausto. Para efeito de comparação, um sistema de fechamento diário como o da Apple ou da Samsung dirá para você treinar 30 minutos sem falhar, mesmo no dia seguinte a uma maratona, o que me dá vontade de ignorá-lo.
Mais especificamente, gosto dos lembretes de movimento de hora em hora do Fitbit, que me impedem de ficar muito rígido e sedentário ao longo do dia. Com a Garmin, uso os treinos diários sugeridos pelos relógios para aumentar meu VO2 máximo ou a capacidade do meu corpo de converter oxigênio em energia. Não gostei de ver meu VO2 máximo caindo durante a pandemia, então segui suas sugestões para treinos em pista e corridas aeróbicas baixas até subir cinco pontos de “Bom” para “Excelente” para minha idade.

Infelizmente, você precisa de um relógio Garmin Forerunner ou rastreador Fitbit para acessar essas ferramentas, e quero me concentrar em aplicativos que qualquer pessoa pode usar para motivação, independentemente de qual relógio de fitness você possui.
Faço questão de sair diariamente, seja para caminhadas ou corridas, para dar 10 mil passos por dia (ou perto disso). Às vezes, me sinto cansado demais para correr, mas depois de começar uma caminhada, percebo que fazer tenha energia suficiente. Do contrário, procuro aplicativos como o Fantasy Hike – uma missão protegida por direitos autorais para caminhar até o Monte Ruína Fogo como a Sociedade do Anel – que faz com que cada passo e quilômetro pareça significativo, mesmo se eu não estiver correndo. Eu só queria que não fosse exclusivo para iOS.

Walk the Distance não tem o gancho da fantasia, mas a premissa de somar suas milhas e passos para que você caminhe virtualmente pela Trilha dos Apalaches e compita com outros caminhantes deve dar aos usuários de Android e iOS uma boa motivação.
O mesmo acontece com aplicativos fofos como o Pikmin Bloom, onde mais etapas equivalem a mais companheiros Pikmin em sua equipe, ou aplicativos mais gerais de definição de metas, como o Finch, onde você pode cuidar do seu animal de estimação cuidando de si mesmo.
Caso contrário, eu diria que não tenha medo de usar o modo lo-fi para monitorar o treinamento. Este ano, estou usando um documento do Google para registrar quantas corridas, milhas e etapas concluí por mês para ver se estou no caminho certo para atingir minhas metas anuais. Não tudo precisa passar por um aplicativo específico!
Meus aplicativos de treinamento social favoritos
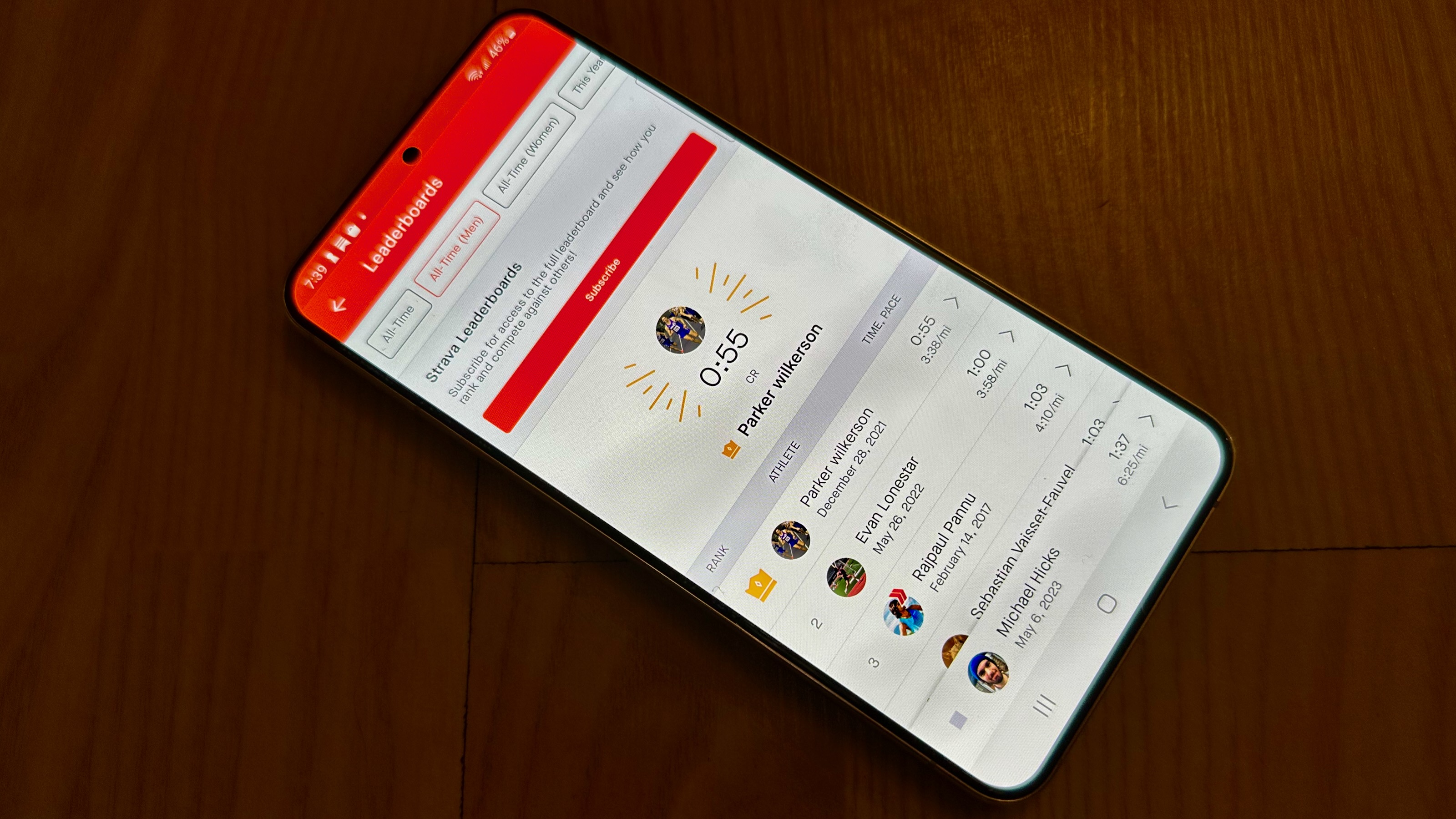
É difícil recomendar qualquer um dos melhores aplicativos de corrida porque (A) eles são todos bastante semelhantes no que oferecem e (B) a escolha dependerá de qual aplicativo seus colegas corredores ou caminhantes usam.
Strava, MapMyRun, Runkeeper, Nike Run Club e outros têm seus pontos fortes com mapas comunitários, segmentos ao vivo, tabelas de classificação, treinamento, clubes de corrida e assim por diante. Mas será uma experiência solitária se você escolher o aplicativo errado, então eu diria que espere para ingressar no clube de corrida local e ver o que eles usam.
Gosto do foco do Strava em segmentos, que faz com que você compita com corredores locais tanto em ritmo quanto em número de vezes completadas. Lutei para ser a lenda local na pista mais próxima com alguns outros corredores, por exemplo, e gosto de competir contra outros (e contra mim mesmo) nos segmentos das minhas rotas de corrida favoritas, já que o Strava tem uma parceria com a Garmin para mostrar Segmentos ao vivo no Forerunner 965.
Não posso dizer com certeza qual aplicativo funcionará melhor para você. Algumas pessoas precisam de competição com amigos (ou estranhos), enquanto outras preferem um jogo ou cenário de fantasia que faça com que cada quilômetro pareça mais significativo. Corredores iniciantes podem precisar de treinamento mais aprofundado, enquanto corredores veteranos desejarão planos de treinamento baseados em IA, como o Garmin Coach, com base em seu nível de condicionamento físico.
O que importa, na minha opinião, é que você precisa encontrar um objetivo concreto e positivo. Simplesmente dizer a si mesmo para caminhar ou correr todos os dias inevitavelmente o levará a perder a motivação ou a treinar demais até se machucar.
Mas se você está levando seus entes queridos para Mordor enquanto trabalha em seu audiolivro ou podcast backlog, você está se preparando para o sucesso! Ou, para corredores mais sérios, buscar metas concretas de condicionamento físico – como o maior número de quilômetros em seu grupo Strava ou um aumento significativo de VO2 máximo – tem mais chances de sucesso do que apenas tentar correr forte todos os dias.
.









