.
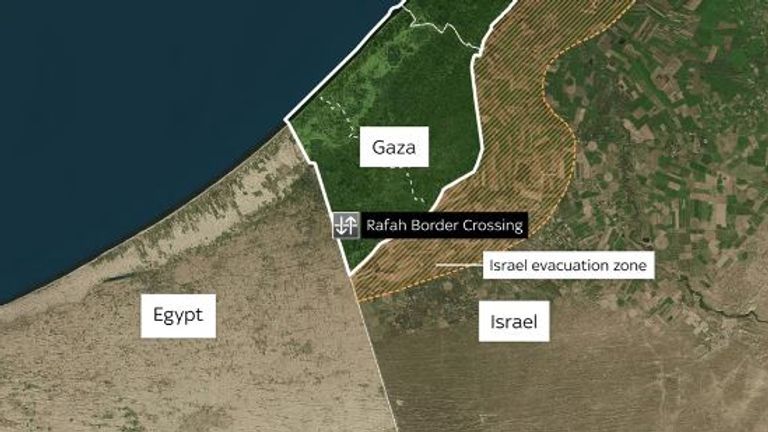
No extremo sul de Gaza, na fronteira com o Egito, fica a poeirenta e caótica passagem fronteiriça de Rafah.
Esforços diplomáticos estão em andamento abri-lo por algumas horas para estrangeiros e habitantes de Gaza que possuam dupla nacionalidade.
Significaria uma fuga da guerra para um número limitado de palestinianos. Mas a maior parte dos 2,3 milhões de habitantes de Gaza permanecerá presa dentro do enclave devastado pela guerra.
Rafah é a única porta de entrada de Gaza para o resto do mundo que não é directamente controlada por Israel.
Está sob o controle de Egito como parte de um acordo com Israel e a União Europeia.
No entanto, nunca foi uma passagem de fronteira normal e totalmente aberta.
Acompanhe ao vivo: reivindicações de Israel de ‘Não há crise em Gaza’
Ao longo dos anos, esteve fechado durante dias, semanas e meses seguidos. Quando abre, geralmente é intermitente e pode fechar novamente de repente.
O povo de Gaza nunca se sabe quando abrirá ou por quanto tempo, por isso é impossível para eles planejarem suas vidas.
Se você ficar preso fora de Gaza quando Rafah fechar, não há chance de voltar novamente.
Mesmo nas melhores condições, a travessia não é confiável e é instável.
O que sempre chamava a atenção nas reportagens de Rafah era o desespero absoluto e o desespero dos habitantes de Gaza que esperavam para viajar.
Quando estava aberta, a travessia ficava lotada de pessoas, às vezes milhares, todas sem saber se conseguiriam realmente conseguir.
As mulheres ficavam horas sentadas em malas, as crianças brincavam no chão, uma cacofonia de táxis, carros e carroças puxadas por burros, todos disputando espaço.
E no meio disso tudo os reencontros e despedidas de famílias que não sabiam quando se voltariam a ver. Nunca tenho certeza de quando a fronteira estará aberta ou fechada.
Consulte Mais informação:
As raízes profundas do conflito israelo-palestiniano
Em imagens: como a guerra Israel-Hamas se intensificou
O Egipto controla rigidamente a passagem de Rafah e os palestinianos acusam-no de ser cúmplice no cerco a Gaza ao recusar-se a manter a fronteira permanentemente aberta 24 horas por dia.
Não há incentivo para que o Egipto abra agora esta passagem e permita que centenas de milhares de habitantes de Gaza escapem da guerra.
Se assim fosse, o povo de Gaza tornar-se-ia um problema do Egipto e essa é a última coisa que o Cairo deseja.
.