.
Quando a Organização Mundial da Saúde declarou a COVID-19 uma pandemia em 11 de março de 2020, os humanos eram a única espécie com casos relatados da doença. Embora as primeiras análises genéticas tenham apontado os morcegos-ferradura como hospedeiros evolutivos do SARS-CoV-2, o vírus que causa a COVID-19, nenhum relato havia surgido indicando que ele poderia ser transmitido de humanos para outras espécies animais.
Menos de duas semanas depois, um relatório da Bélgica marcou a primeira infecção em um gato doméstico — presumivelmente por seu dono. O verão de 2020 viu notícias de surtos de COVID-19 e abates subsequentes em fazendas de visons por toda a Europa e temores de pedidos semelhantes de abate na América do Norte. Humanos e outros animais em fazendas de visons e ao redor delas testaram positivo, levantando questões sobre o potencial de um reservatório secundário de COVID-19 na vida selvagem. Ou seja, o vírus poderia infectar e estabelecer um ciclo de transmissão em uma espécie diferente daquela em que se originou.
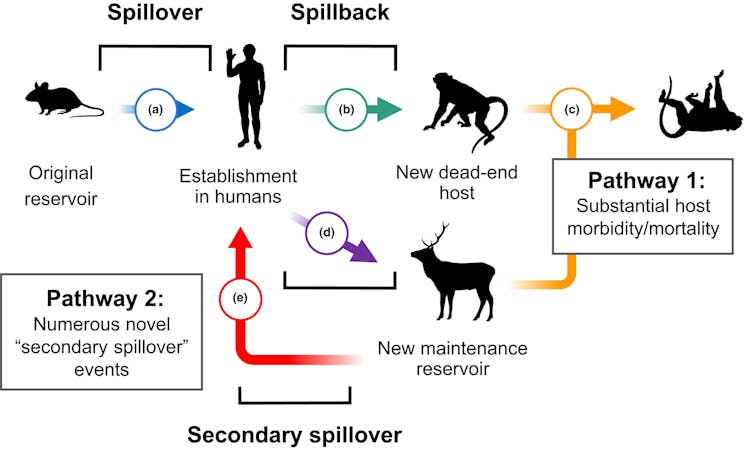
Pesquisadores documentaram esse fenômeno de transmissão de humano para animal, coloquialmente chamado de spillback ou transmissão zoonótica reversa, tanto em animais domésticos quanto selvagens. A vida selvagem pode ser infectada diretamente por humanos ou indiretamente por animais domésticos infectados por humanos. Esse efeito trampolim fornece novas oportunidades para os patógenos evoluírem e pode mudar radicalmente como eles se espalham, como visto com a gripe e a tuberculose.
Fagre et al. 2022/Cartas de ecologia, CC BY-NC-ND
Por exemplo, o spillback tem sido uma ameaça de longa data para os grandes símios ameaçados, mesmo entre populações com contato humano pouco frequente. Os chimpanzés do Parque Nacional de Gombe, tornados famosos pelo trabalho de Jane Goodall, sofreram surtos de sarampo e outras doenças respiratórias provavelmente resultantes da persistência ambiental de patógenos disseminados por pessoas que vivem nas proximidades ou por ecoturistas.
Somos pesquisadores que estudam os mecanismos que impulsionam a transmissão de doenças entre espécies e como as doenças afetam tanto a conservação da vida selvagem quanto as pessoas. Surtos emergentes ressaltaram a importância de entender como as ameaças à saúde da vida selvagem moldam o surgimento e a disseminação de patógenos zoonóticos. Nossa pesquisa sugere que olhar para surtos históricos pode ajudar a prever e prevenir a próxima pandemia.
O efeito de retrocesso já aconteceu antes
Nosso grupo de pesquisa queria avaliar com que frequência o spillback foi relatado nos anos que antecederam a pandemia da COVID-19. Uma análise retrospectiva não apenas nos permite identificar tendências ou barreiras específicas no relato de eventos de spillback, mas também nos ajuda a entender onde novas ameaças emergentes são mais prováveis.
Examinamos eventos históricos de spillback envolvendo diferentes grupos de patógenos em todo o reino animal, levando em conta variações em geografia, métodos e tamanhos de amostra. Sintetizamos relatórios científicos de spillback ao longo de quase um século antes da pandemia de COVID-19 – da década de 1920 a 2019 – que incluíam doenças que variavam de salmonela e parasitas intestinais a tuberculose humana, gripe e poliomielite.
Também estávamos interessados em determinar se o viés de detecção e relato pode influenciar o que se sabe sobre a transmissão de patógenos de humanos para animais. A megafauna carismática — frequentemente definida como mamíferos maiores, como pandas, gorilas, elefantes e baleias, que evocam emoção nas pessoas — tende a ser super-representada na epidemiologia da vida selvagem e nos esforços de conservação. Elas recebem mais atenção pública e financiamento do que espécies menores e menos visíveis.
Para complicar ainda mais, há dificuldades em monitorar populações selvagens de pequenos animais, pois eles se decompõem rapidamente e são frequentemente catados por animais maiores. Isso reduz drasticamente a janela de tempo durante a qual os pesquisadores podem investigar surtos e coletar amostras.

Christopher Kimmel/Momento via Getty Images
Os resultados da nossa análise histórica apoiam nossas suspeitas de que a maioria dos relatórios descreveu surtos em grandes megafaunas carismáticas. Muitos eram cativos, como em zoológicos ou centros de reabilitação, ou semi-cativos, como grandes primatas bem estudados.
Apesar da ladainha de artigos publicados sobre novos patógenos descobertos em morcegos e roedores, o número de estudos examinando patógenos transmitidos de humanos para esses animais foi escasso. No entanto, pequenos mamíferos que ocupam nichos ecológicos diversos, incluindo animais que vivem perto de habitações humanas – como camundongos, ratos e gambás – podem ter maior probabilidade não apenas de compartilhar seus patógenos com pessoas, mas também de serem infectados por patógenos humanos.
COVID-19 e gripe pandêmica
Em nossa análise histórica de spillback antes da pandemia de COVID-19, a única evidência que encontramos apoiando o estabelecimento de um patógeno humano em uma população de vida selvagem foram dois relatórios de 2019 descrevendo a infecção por H1N1 em gambás listrados. Assim como os coronavírus, os vírus influenza A, como o H1N1, são hábeis em trocar de hospedeiros e podem infectar uma ampla gama de espécies.
Ao contrário dos coronavírus, no entanto, sua transmissão generalizada é facilitada por aves aquáticas migratórias, como patos e gansos. Exatamente como esses gambás foram infectados com H1N1 e por quanto tempo permanece obscuro.
Pouco depois de concluirmos a análise para nosso estudo, relatórios descrevendo a infecção generalizada de veados-de-cauda-branca por COVID-19 em toda a América do Norte começaram a surgir em novembro de 2021. Em algumas áreas, a prevalência da infecção chegou a 80%, apesar da pouca evidência de doença nos veados.
Este mamífero onipresente efetivamente se tornou um reservatório secundário da COVID-19 na América do Norte. Além disso, evidências genéticas sugerem que o SARS-CoV-2 evolui três vezes mais rápido em veados-de-cauda-branca do que em humanos, aumentando potencialmente o risco de semear novas variantes em humanos e outros animais. Já há evidências de transmissão de veados para humanos de uma variante da COVID-19 nunca vista antes.
Existem mais de 30 milhões de veados-de-cauda-branca na América do Norte, muitos em áreas agrícolas e suburbanas. Os esforços de vigilância para monitorar a evolução viral em veados-de-cauda-branca podem ajudar a identificar variantes emergentes e transmissão adicional de populações de veados para pessoas ou animais domésticos.
Investigações em espécies relacionadas revelaram que o risco de spillback varia. Por exemplo, veados de cauda branca e veados-mula são altamente suscetíveis à COVID-19 em laboratório, enquanto alces não.
H5N1 e o rebanho leiteiro dos EUA
Desde 2022, a disseminação do H5N1 afetou uma ampla gama de espécies de aves e mamíferos ao redor do globo – raposas, gambás, guaxinins, gambás, ursos polares, coiotes e focas, para citar alguns. Algumas dessas populações estão ameaçadas ou em perigo, e esforços agressivos de vigilância para monitorar a disseminação viral estão em andamento.
No início deste ano, o Departamento de Agricultura dos EUA relatou a presença do H5N1 no leite de vacas leiteiras. Análises genéticas apontam para uma introdução do vírus em vacas já em dezembro de 2023, provavelmente no Texas Panhandle. Desde então, ele afetou 178 rebanhos de gado em 13 estados até agosto de 2024.
Como o vírus entrou nas populações de vacas leiteiras permanece indeterminado, mas provavelmente foi por aves aquáticas migratórias infectadas com o vírus. Esforços para delinear exatamente como o vírus se move entre rebanhos estão em andamento, embora pareça que o equipamento de ordenha contaminado, em vez da transmissão por aerossol, pode ser o culpado.

Jacob Wackerhausen/iStock via Getty Images Plus
Dada a capacidade dos vírus influenza A, como a gripe aviária, de infectar uma ampla gama de espécies, é essencial que os esforços de vigilância visem não apenas as vacas leiteiras, mas também os animais que vivem nas fazendas afetadas ou ao redor delas. O monitoramento de áreas de alto risco para transmissão entre espécies, como onde o gado, a vida selvagem e as pessoas interagem, fornece informações não apenas sobre o quão disseminada uma doença está em uma determinada população — neste caso, vacas leiteiras — mas também permite que os pesquisadores identifiquem espécies suscetíveis que entram em contato com elas.
Até o momento, o H5N1 foi detectado em vários animais encontrados mortos em fazendas leiteiras afetadas, incluindo gatos, pássaros e um guaxinim. Em agosto de 2024, quatro pessoas em contato próximo com vacas leiteiras infectadas testaram positivo, uma das quais desenvolveu sintomas respiratórios. Outras espécies de animais selvagens e domésticos ainda estão em risco. Esforços de vigilância semelhantes estão em andamento para monitorar a transmissão do H5N1 de aves para humanos.
Os humanos são apenas uma parte da rede
A linguagem frequentemente usada para descrever a transmissão entre espécies falha em encapsular sua complexidade e nuances. Dado o número de espécies que foram infectadas com COVID-19 ao longo da pandemia, muitos cientistas pediram a limitação do uso dos termos spillover e spillback porque eles descrevem a transmissão de patógenos de e para humanos. Isso sugere que a doença e suas implicações começam e terminam com humanos.
Considerar os humanos como um nó em uma grande rede de possibilidades de transmissão pode ajudar os pesquisadores a monitorar de forma mais eficaz a COVID-19, H5N1 e outras zoonoses emergentes. Isso inclui abordagens de pensamento sistêmico, como One Health ou Planetary Health, que capturam a interdependência humana com a saúde do ambiente total.
.









