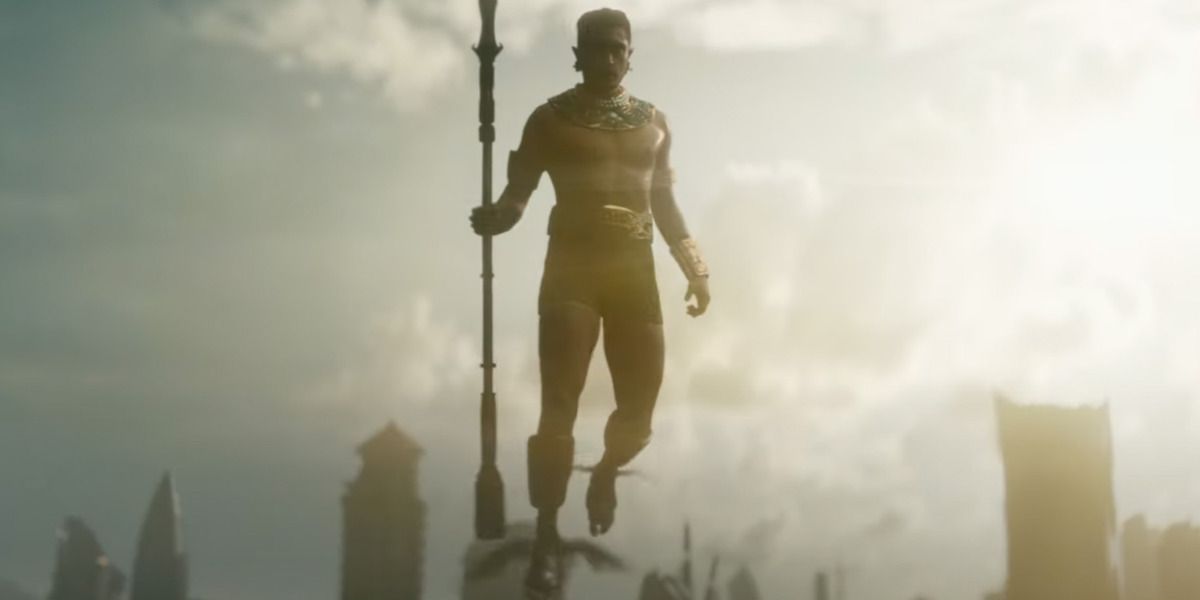.
O último episódio da série Pitch Meeting da Screen Rant aponta para Black Panther: Wakanda Forever, o filme final da Fase Quatro do MCU.
Spoilers para Black Panther: Wakanda Forever abaixo!Rant de telapróprio Reunião de apresentação série retorna e volta ao Universo Cinematográfico da Marvel para focar em Pantera Negra: Wakanda para sempre. Situado um ano após a morte do Rei T’Challa (Chadwick Boseman), o reino de Wakanda luta para preencher o vazio deixado pela ausência de seu líder enquanto a Rainha Ramonda (Angela Bassett) e Shuri (Letitia Wright) lutam com a dor de sua perda. No entanto, depois que forças externas encontram vibranium debaixo d’água, Namor (Tenoch Huerta) ameaça travar uma guerra no mundo para proteger sua casa submarina, visando Wakanda primeiro quando eles optam por não formar uma aliança com Talokan.
Uma semana após a estreia do filme, Rant de telao mais recente Reunião de apresentação episódio se concentra em Pantera Negra: Wakanda para sempre. O vídeo destaca com humor as muitas falhas percebidas do filme, incluindo várias decisões questionáveis, o poder da montagem e a rápida cura de Shuri. Confira o Reunião de apresentação episódio abaixo:
Black Panther: Wakanda Forever Big Battle Scene Críticas explicadas
Embora o mais recente Reunião de apresentação O episódio gerou várias críticas, muitas foram direcionadas a decisões estranhas de vários personagens, incluindo a falta de apoio adequado dado a Dora Milaje General Okoye (Danai Gurira) e Shuri enquanto tentavam extrair Riri Williams (Dominique Thorne) do MIT, a tentativa de Namor de matar Riri, embora o governo dos Estados Unidos provavelmente tenha planos de construir outro detector de vibranium de qualquer maneira, ou a semana arbitrária dada a Shuri para se juntar a Namor em sua guerra depois que ele acabou de assassinar a Rainha. No entanto, o Pantera Negra: Wakanda para sempreO vídeo focado em grande parte destacou aquele que levou à batalha final do filme, da qual eles escolheram lutar contra Namor e seu exército na água. Dado que é de onde eles vêm, isso foi visto por muitos como uma escolha desconcertante, visto que Talokanil estaria no seu ponto mais forte, enquanto Wakanda estaria em desvantagem.
Após o ataque de Namor a Wakanda, Shuri e Riri deduziram que o governante Talokan respira através de sua pele e precisa manter a umidade em seu corpo para manter sua força em níveis elevados. O sistema respiratório do Talokanil não funciona da mesma forma que seu governante, mas seu poder também é protegido pelo mar. No entanto, Shuri trazendo os militares wakandanos para o oceano em um ataque surpresa é algo que Namor não esperava, levando ela e suas forças a dominar o antagonista do filme e criar uma trégua entre as duas nações.
A outra grande crítica de Pantera Negra: Wakanda para sempreA grande cena de batalha de Namor surgiu da decisão de colocá-la em torno de uma tela verde, em vez das práticas construídas para o ataque de Namor a Wakanda, perto da metade do filme. Com o original Pantera negra filme tendo recebido críticas generalizadas pelo CGI de má qualidade na luta final entre T’Challa e Erik Killmonger, a decisão de ir para outra luta pesada em CGI na mesma linha de outros projetos do MCU, em vez de um conflito mais íntimo entre Shuri e Namor , a sequência seguindo um caminho semelhante deixou muitos públicos desapontados com a falta de não aprenderem a lição de seu passado. Com o resultado de Pantera Negra: Wakanda para sempre pelo menos entregando um momento de silêncio emocional para Boseman, a sequência do MCU ainda viu sua batalha final amplamente perdoada pelo público.
Principais datas de lançamento
.