.
O primeiro grande momento na noite da eleição no Reino Unido, depois do fechamento das urnas, acontece às 22h em ponto. É quando a pesquisa de boca de urna é divulgada e as comportas dos comentários da mídia são reabertas após um dia de silêncio da mídia, de acordo com as regras de transmissão.
Muitas pesquisas são publicadas durante uma campanha eleitoral, mas a pesquisa de boca de urna é diferente. Enquanto a maioria das outras pesquisas são instantâneos da intenção de voto em um ponto no tempo, a pesquisa de boca de urna é essencialmente o que todos desejam que uma pesquisa seja – uma previsão do resultado da eleição.
A pesquisa de boca de urna é paga por um consórcio de mídia formado pela BBC, Sky News e ITV. A empresa de pesquisa de mercado e pesquisas de opinião Ipsos coleta os dados, que são analisados pela equipe de especialistas em pesquisa de boca de urna de um bunker secreto no centro de Londres.
Como funciona a pesquisa de boca de urna?
Pesquisas de opinião durante uma eleição tendem a lhe dizer uma, ou ambas, de duas coisas: a parcela de votos projetada para cada partido político e o número projetado de assentos que cada partido obterá. Eles fazem essas projeções entrevistando um painel de pessoas por telefone ou convidando-as a responder a uma pesquisa online, onde perguntam em quem planejam votar. Os pesquisadores agregam e ponderam as respostas para chegar à sua expectativa geral sobre como o país votaria.
Embora a maioria das empresas de pesquisa faça um excelente trabalho, as pessoas que respondem a essas pesquisas podem não estar prevendo seu próprio comportamento muito bem, e há muitas escolhas estatísticas que precisam ser feitas ao analisar suas respostas. Portanto, essas pesquisas de opinião são uma estimativa – um melhor palpite com base naquele dia.
A pesquisa de saída é um tipo diferente de pesquisa. Em vez de perguntar às pessoas o que elas acham que podem fazer, ela pergunta o que elas acabaram de fazer.
Os trabalhadores de campo da Ipsos ficam do lado de fora de 100-150 seções eleitorais cuidadosamente selecionadas. Eles contam o número de pessoas que saem e pedem a um certo número delas para preencher uma réplica da cédula secreta. Elas são contadas e a mudança nos votos para cada partido, em comparação com a eleição anterior, é analisada ao longo do dia até o fechamento das urnas.
Este método contorna muitos dos problemas enfrentados pelos pesquisadores de pesquisa. É uma votação secreta, então as pessoas não se sentem tão envergonhadas para serem honestas. Elas estão repetindo uma ação, em vez de imaginar algo que podem fazer. Sabemos que elas votaram em vez de ter que estimar sua probabilidade de comparecer. Mais pessoas concordam em participar do que em pesquisas de opinião também.
É por isso que, em vez de ser uma projeção, como são as pesquisas de opinião, é uma previsão.
Quão precisa é a pesquisa de boca de urna?
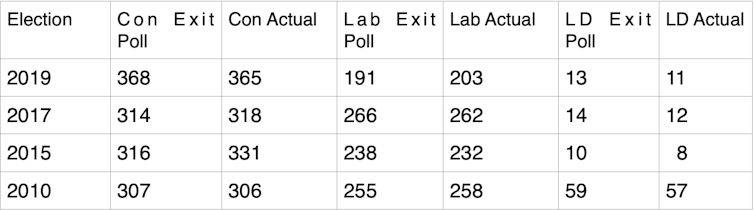
Na maioria dos anos, a pesquisa de boca de urna foi notavelmente precisa. Em 2019, ela estava fora por apenas três assentos para os Conservadores. Ela superestimou ligeiramente o sucesso do Partido Nacional Escocês e do Partido Liberal Democrata, o que significa que estava 12 assentos abaixo do resultado obtido pelo Partido Trabalhista. Mas o quadro geral foi surpreendentemente semelhante ao resultado final.
J Língua.CC BY-ND
Em 2017, a pesquisa de boca de urna revelou diferença de apenas quatro assentos para os dois principais partidos, e de duas cadeiras para os Lib Dems e os partidos nacionais.
Em 2015, a pesquisa de boca de urna previu corretamente os Conservadores como o maior partido, o que foi uma surpresa porque as pesquisas, até aquele ponto, tinham deixado todos esperando um parlamento suspenso. Naquele ano, a Câmara dos Lordes acabou lançando um inquérito sobre a indústria de pesquisas por causa dessa falha em perceber o que estava prestes a acontecer.

Quer mais cobertura eleitoral dos especialistas acadêmicos do The Conversation? Nas próximas semanas, traremos a você análises informadas dos desenvolvimentos da campanha e verificaremos os fatos das alegações que estão sendo feitas.
Inscreva-se para receber nosso novo boletim semanal sobre eleiçõesentregue toda sexta-feira durante a campanha e depois dela.
A pesquisa de boca de urna teve algumas falhas notáveis próprias, no entanto. Em 1992, houve pesquisas de boca de urna separadas para diferentes empresas de mídia. Ambas previram um parlamento suspenso, quando na verdade os conservadores de John Major ganharam uma maioria de 21 cadeiras.
No geral, porém, isso nos dá uma boa ideia da história que está prestes a se desenrolar da noite para o dia.
Isso significa que posso ir para a cama às dez e cinco?
Os verdadeiros nerds não conseguiriam dormir na noite da eleição com toda a excitação se desenrolando. Mas a maioria das pessoas vai se perguntar se conseguirão dormir um pouco porque a pesquisa de boca de urna nos diz o resultado bem a tempo para o nosso chocolate quente.
Mas sempre há uma chance de a pesquisa de boca de urna deixar passar algo – e isso é um pouco mais provável neste ano, em particular. Isso não é por causa de algo que poderia ser evitado, mas porque o mapa eleitoral foi redesenhado como resultado de mudanças de limites. Portanto, há mais incerteza em torno do rastreamento das mudanças nos votos.
Alguns círculos eleitorais não existem mais, alguns foram fundidos e alguns foram criados a partir de fragmentos de vários outros círculos eleitorais. Então, quando os trabalhadores da pesquisa de boca de urna tentam medir as mudanças da última eleição para esta eleição, eles estão trabalhando com um quadro muito mais complexo. A escala das oscilações esperadas em 2024 também torna o trabalho mais complicado.
Se você precisar, um bom truque é assistir à pesquisa de boca de urna, dormir por algumas horas e acordar novamente por volta das 3 da manhã para ver como está indo. Então, ou fique viciado e se amarre para o resto da manhã, ou durma mais um pouco e volte às 6 da manhã.
Mas esta será uma eleição histórica, e você não gostaria de ter medo de ficar de fora, então eu sempre recomendo ficar ligado a noite toda.
.