.

A subida do nível do mar está a afectar comunidades costeiras em todo o mundo, especialmente aquelas como Honolulu, na foto, que estão localizadas em ilhas. Crédito: Programa NOAA Teacher at Sea, navio NOAA HI’IALAKAI
Um conjunto de dados de longo prazo sobre o nível do mar mostra que as alturas da superfície oceânica continuam a aumentar a taxas cada vez mais rápidas ao longo de décadas de observações.
O nível médio global do mar aumentou cerca de 0,76 centímetros entre 2022 e 2023, um salto relativamente grande devido principalmente ao aquecimento do clima e ao desenvolvimento de um forte El Niño. O aumento total equivale a drenar um quarto do Lago Superior para o oceano ao longo de um ano.
Esta análise liderada pela NASA baseia-se num conjunto de dados do nível do mar com mais de 30 anos de observações por satélite, começando com a missão EUA-França TOPEX/Poseidon, lançada em 1992. A missão Sentinel-6 Michael Freilich, lançada em Novembro de 2020 é o mais recente de uma série de satélites que contribuíram para este recorde do nível do mar.
Os dados mostram que o nível médio global do mar aumentou um total de cerca de 4 polegadas (9,4 centímetros) desde 1993. A taxa deste aumento também acelerou, mais do que duplicando de 0,07 polegadas (0,18 centímetros) por ano em 1993 para a taxa actual. de 0,17 polegadas (0,42 centímetros) por ano.
“As atuais taxas de aceleração significam que estamos no caminho certo para adicionar mais 20 centímetros ao nível médio global do mar até 2050, duplicando a quantidade de mudanças nas próximas três décadas em comparação com os 100 anos anteriores e aumentando a frequência e os impactos das inundações em todo o mundo. mundo”, disse Nadya Vinogradova Shiffer, diretora da equipe de mudança do nível do mar da NASA e do programa de física oceânica em Washington.
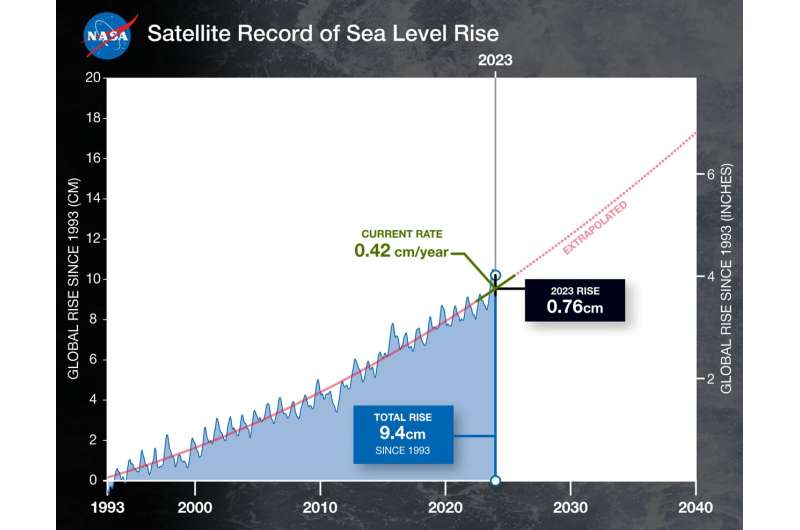
Este gráfico mostra o nível médio global do mar (em azul) desde 1993, medido por uma série de cinco satélites. A linha vermelha contínua indica a trajetória deste aumento, que mais do que duplicou nas últimas três décadas. A linha vermelha pontilhada projeta o futuro aumento do nível do mar. Crédito: NASA-JPL/Caltech
Efeitos sazonais
O nível global do mar registou um salto significativo de 2022 para 2023 devido principalmente a uma mudança entre as condições de La Niña e de El Niño. Um suave La Niña de 2021 a 2022 resultou num aumento do nível do mar abaixo do esperado naquele ano. Um forte El Niño desenvolveu-se em 2023, ajudando a aumentar o aumento médio da altura da superfície do mar.
La Niña é caracterizada por temperaturas oceânicas mais frias do que o normal no Oceano Pacífico equatorial. El Niño envolve temperaturas oceânicas mais quentes do que a média no Pacífico equatorial. Ambos os fenómenos climáticos periódicos afectam os padrões de precipitação e neve, bem como os níveis do mar em todo o mundo.
“Durante o La Niña, a chuva que normalmente cai no oceano cai na terra, retirando temporariamente a água do oceano e reduzindo o nível do mar”, disse Josh Willis, pesquisador do nível do mar no Laboratório de Propulsão a Jato da NASA no sul da Califórnia. “Em anos de El Niño, grande parte da chuva que normalmente cai em terra acaba no oceano, o que eleva temporariamente o nível do mar”.
Uma pegada humana
Os fenómenos climáticos sazonais ou periódicos podem afectar o nível médio global do mar de ano para ano. Mas a tendência subjacente há mais de três décadas tem sido o aumento da altura dos oceanos como resposta directa ao aquecimento global devido ao calor excessivo retido pelos gases com efeito de estufa na atmosfera da Terra.
“Conjuntos de dados de longo prazo, como este registro de satélite de 30 anos, nos permitem diferenciar entre os efeitos de curto prazo no nível do mar, como o El Niño, e as tendências que nos permitem saber para onde está indo o nível do mar”, disse Ben Hamlington, líder do mar da NASA. equipe de mudança de nível no JPL.
Estas observações multidecadais não seriam possíveis sem a cooperação internacional contínua, bem como as inovações científicas e técnicas da NASA e de outras agências espaciais. Especificamente, os altímetros de radar ajudaram a produzir medições cada vez mais precisas do nível do mar em todo o mundo. Para calcular a altura do oceano, esses instrumentos refletem sinais de micro-ondas na superfície do mar, registrando o tempo que o sinal leva para viajar de um satélite até a Terra e voltar, bem como a força do sinal de retorno.
Os pesquisadores também comparam periodicamente essas medições do nível do mar com dados de outras fontes. Isso inclui medidores de maré, bem como medições por satélite de fatores como o vapor de água atmosférico e o campo gravitacional da Terra, que podem afetar a precisão das medições do nível do mar. Utilizando essas informações, os investigadores recalibraram o conjunto de dados de 30 anos, resultando em atualizações dos níveis do mar em alguns anos anteriores. Isso inclui um aumento do nível do mar de 0,08 polegadas (0,21 centímetros) de 2021 a 2022.
Quando os investigadores combinam dados de altimetria dos oceanos baseados no espaço com mais de um século de observações de fontes baseadas na superfície, como medidores de marés, a informação melhora dramaticamente a nossa compreensão de como a altura da superfície do mar está a mudar à escala global. Quando estas medições do nível do mar são combinadas com outras informações, incluindo a temperatura do oceano, a perda de gelo e o movimento da terra, os cientistas podem decifrar porquê e como o nível do mar está a subir.
Citação: Nova análise vê aumento no nível global do mar em 2023 devido ao El Niño (2024, 21 de março) recuperado em 22 de março de 2024 em https://phys.org/news/2024-03-análise-spike-global-sea-due.html
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa privada, nenhuma parte pode ser reproduzida sem permissão por escrito. O conteúdo é fornecido apenas para fins informativos.
.